療器械唯一標識(unique device identifier,UDI)目前已成為解決醫療器械全球監管問題的通用語言。自2013年9月美國食品藥品管理局(Food and Drug Administration,FDA)發布醫療器械唯一標識系統(unique device identification system,UDI system)法規、正式啟動UDI實施工作以來,規范醫療領域數據格式,提高臨床數據釆集的準確性,同時也為UDI全球協調工作提供了經驗。本研究擬結合本所研究人員親赴FDA展開的UDI調研情況,系統概述美國UDI系統實施的法規體系和組織架構以及UDI系統項目推進情況,研討美國UDI系統的具體實施方案,分析UDI發碼機構、全球UDI數據庫等美國特色的UDI系統實現方式,為我國開展和推進UDI實施工作提供借鑒和思路。
Progress in the Implementation of Unique Device Identification(UDI)System in the US
YI Li,YU Xinhua*
(Institute of Medical Device Standardisation Administration,National Institutes for Food and Drug Control,Beijing 100050,China)
[Abstract]The unique device identifier(UDI)has become the common language for identification of medical device globally.Since September 2013,the US Food and Drug Administration( FDA)issued unique device identification system(UDI system)regulations to establish a UDI system,which not only standardized data formats for healthcare industry and improved the accuracy of collecting clinical data,but also provided experience for UDI's global harmonization efforts.Combining with the experience from the field study to US FDA about UDI in 2016,this article outlines the regulatory system and organizational structure of UDI system implementation and the promotion of UDI system projects,discusses the specific implementation plan of UDI system in the United States,and analyzes the UDI issuing agency and global UDI database.The UDI system implementation method with United States characteristics provides experience for China to carry out and promote the implementation of UDI system.
[Key Words]Unique device identifier(UDI);The US Food and Drug Administration;UDI system regulatory system and organizational structure;UDIsystem project promotion
醫療器械唯一標識(unique device identifier,UDI)目前已成為解決醫療器械全球監管問題的通用語言。國際醫療器械監管機構論壇(international medical device regulators forum,IMDRF)于2013年12月發布《UDI指南》【1】,拉開了全球實施UDI的序幕。由于《UDI指南》只是一個框架性文件,不包括具體應用層面的指導,2017年9月,IMDRF重開UDI工作組,并于2019年3月發布《UDI應用指南》和兩個信息文件《在電子健康系統中記錄UDI)<UDI數據元素在不同IMDRF成員國的使用》,給各國實施UDI提供細化的指導。
我國國家藥品監督管理局(NMPA)于2019年8月發布《醫療器械唯一標識系統規則》
【2】,自2019年10月1日起正式實施。全球范圍內,美國、歐盟、沙特阿拉伯和韓國等國家和地區也已經發布UDI相關的法規和指導性文件。美國是首個在國家層面、由政府以法規形式實施醫療器械唯一標識系統(unique device identification system,UDI system)項目的國家,當前已經實施6年。現本研究擬結合本所研究人員親赴美國食品藥品管理局(Food and Drug Administra tion,FDA)展開UDI調研的情況,系統概述美國UDI系統實施的法規體系和組織架構以及UDI系統項目推進情況,研討美國UDI系統的具體實施方案,分析UDI發碼機構、全球UDI數據庫等美國特色的UDI系統實現方式,為我國開展和推進UDI實施工作提供借鑒和思路。
1、美國FDA UDI法規制定背景和現狀
1.1美國FDAUDI實施背景
1999年,美國國家醫學院(Institute of Medicine)發布了研究報告《人非圣賢》,報告指出,錯誤地使用藥物和器械導致的醫療錯誤是醫療事故的主要原因,而醫療錯誤大多是可以避免的,通過床前掃碼能夠有效地避免藥物和器械的誤用,從而極大程度地降低醫療成本。本研究報告是美國FDA積極推行藥品和醫療器械條形碼管理的契機【3】。
2004年,FDA頒布法規,要求在藥品標簽上使用條形碼識別,在起草時,FDA針對是否應將此項法規推廣至醫療器械領域公開征求了意見,在審議過程中,FDA決定不對醫療器械應用條形碼規則,并表示此類器械缺乏與國家藥品代碼(national drug code)系統相類似的標準和唯一識別系統,但UDI有助于減少醫療錯誤,便于召回,可識別器械的兼容性或過敏反應(如MRI和乳膠)、改善庫存控制、完善報銷方式并減少假冒產品。FDA一直在積極開展相關研究,推動UDI的實施,并委托相關咨詢機構開展研究,發布了研究報告,并開展了法規實施的影響力分析,認為UDI實施利大于弊【4】。
1.2美國FDA實施UDI的法規體系
基于之前的研究成果,2007年《FDA補充法案》【5】確立了美國FDA實施UDI系統的法規依據,明確了可以發布UDI法規,要求在醫療器械的標簽上賦有唯一性的標識,以便在流通和使用環節充分識別醫療器械。2012年《FDA安全和創新法案》【6】確立了UDI系統實施的時間框架,要求UDI法規草案在2012年12月31日前完成,并在征求意見結束后6個月內發布,植入器械、生命支持/生命維持類器械需要在法規發布后兩年內實施UDI。2013年9月,FDA發布UDI法規,計劃通過7年時間逐步實施UDI。
2013年IMDRF發布的《UDI指南》明確提出,所有UDI應用的利益相關者(從生產企業到醫療機構和患者),只有在其各工作流程系統中使用UDI,才能體現出UDI的益處。UDI規則發布后,美國同時也對聯邦法規第21篇(Code of Federal Regulations Title 21,21CFR)做了一系列適應性修訂,在諸多章節中加入了UDI相關內容,例如第803部分——醫療器械報告,第810部分——醫療器械召回主管機構,第820部分——質量系統法規等,促進各方在相關環節應用UDI,從而最大程度發揮UDI的作用。FDA陸續發布了一系列指南性文件,指導企業實施UDI。
指南文件包括唯一標識的關鍵性要求,例如數據庫填報、關鍵性技術(如針對醫療器械本體直接標識等)以及特定類型的醫療器械產品(如針對器械包發布的指南等)。FDA并沒有在法規規則的同時一次性發布所有的指南,而是在UDI實施過程中,結合產品的合規日期逐步發布。見表1。
2、美國FDAUDI實施情況
2.1美國FDAUDI施行組織架構
美國FDA成立了專門的UDI工作團隊,具體由FDA設備儀器與放射健康中心(Center for Devices and Radiological Health,CDRH)的監管和統計辦公室(Office of Surveillance and Biometrics,OSB)和FDA信息化辦公室負責。美國UDI數據庫的公眾查詢平臺是由FDA與美國國立醫學圖書館合作建立,可供公眾免費查詢、數據庫下載等。
2.2發碼機構的認可情況
美國FDAUDI規則在很大程度上依賴于國際標準和全球公認的發碼機構。FDA要求UDI的發碼機構能夠滿足以下條件:①為非盈利私人機構或者國家機構;②符合ISO/IEC15459標準的2、4、6部分;③僅使用來自ISO/IEC646標準中的字符和數字;④對所有的使用者一致、公正和合理;⑤能夠協調各利益相關方之間的沖突,該沖突將妨礙申請人構建一個公平和中立標識系統。
美國FDA對發碼機構采取的是認可的方式,滿足條件的發碼機構需向FDA提供書面的申請,并按照要求提供材料和支持文件。FDA認可發碼機構的期限是3年,到期后可以申請更新,FDA保留撤銷認可的權力。發碼機構需要保存貼標商列表并在每年12月31日前以電子文檔的形式向FDA提供該列表。目前,FDA認可了國際物品編碼組織(GS1)、健康行業商務通信委員會(HIBCC)和國際血庫自動化委員會(ICCBBA)3家發碼機構。在數據庫中,根據FDA2016年7月數據,采用GS1作為發碼機構的數據約占80%,HIBCC數據約占20%,MICCBBA數據只有1~2條記錄,基本可以忽略不計。
表1 美國FDAUDI相關法規、文件和合規日期
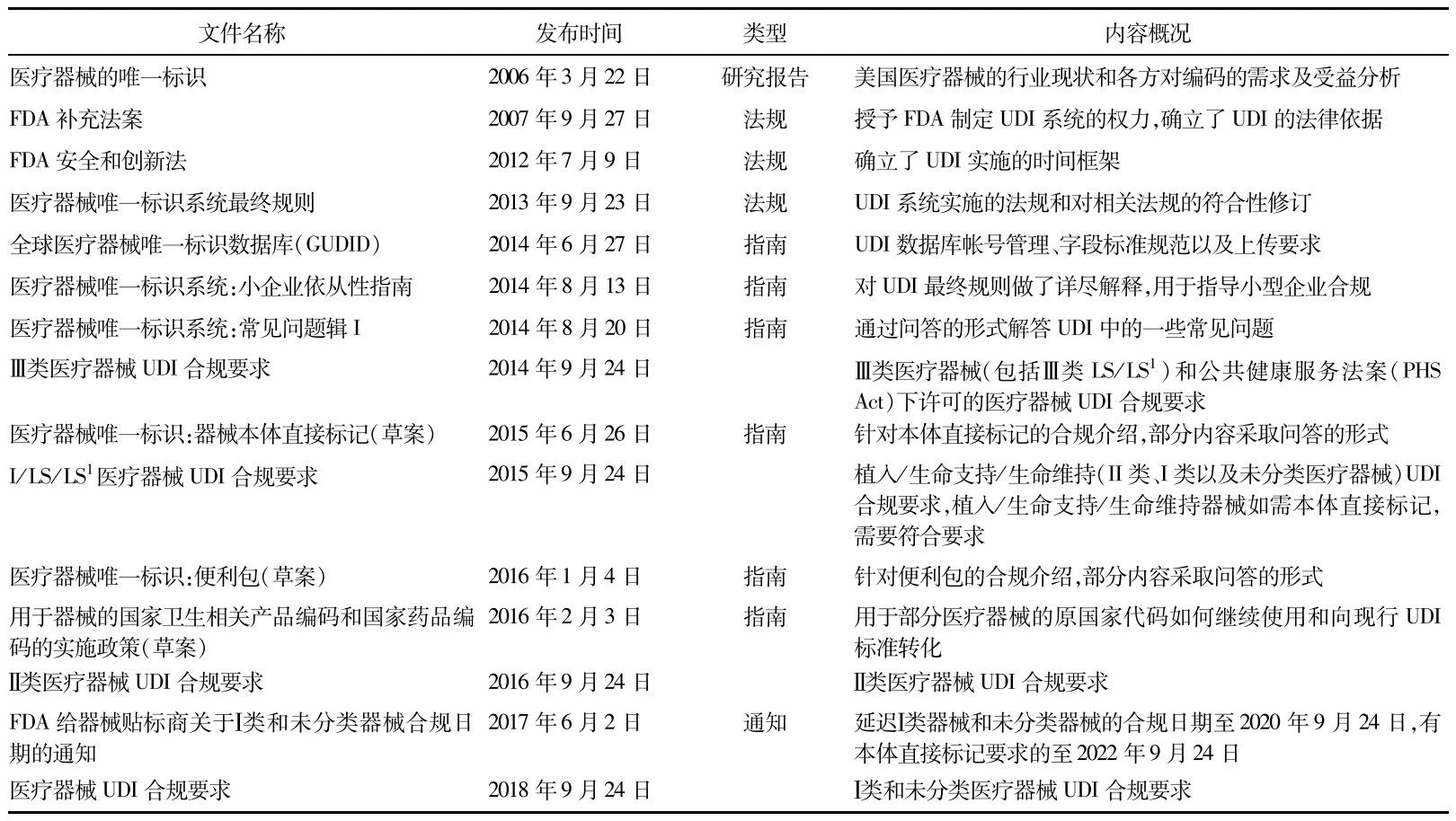
注:除2015年9月24日需要合規的植入/生命支持/生命維持的醫療器械外,其他類型的醫療器械若需本體直接標識要求,合規日期為同類產品合規日期后兩年
2.3UDI數據庫的建設情況
2013年9月20日,美國UDI數據庫正式上線,當時并未開放公眾在線查詢功能。美國FDA于2014年6月發布UDI數據庫指南,指導行業上傳相關數據,指南發布的時間為在首批產品實施UDI前3個月,對首批需要合規的企業具有很好的指導作用。2015年5月4日,FDA與美國國立醫學圖書館合作,發布了GUDID公眾數據平臺(Access GUDID),可供公眾免費査詢、數據庫下載等。數據庫運行至今,經過多次的更新,截止至2019年9月,已經由最初發布時的1.0版更新到最新的2.4.6版【7】。
3、美國FDA UDI實施的經驗
3.1美國FDA UDI成功實施的關鍵因素
美國FDA咨詢系統(FDA helpdesk)是UDI法規實施獲得成功的關鍵因素之一。截至2016年7月25H,UDI咨詢系統總共收到超過20000個問題,超過95%的問題已經成功解答。目前,FDA平均每個月會收到1300個問題,在新的實施日期到來時,收到的提問會增加。赴FDA調研時,按照提問的總類,位于前3位的問題分別是監管政策、技術和賬戶相關的問題。當前,由于數據庫數據量逐漸增加,FDA新設置了數據質量問題的選項。FDA會對收到的問題進行分類,并對比以往回答的問題中是否有相似的問題,從而加快問題回答的速度;對于共性問題,FDA還制定了UDI常見問題集,提高企業對UDI的理解。
工作人員保障充足。美國FDAUDI系統實施的核心團隊有工作人員10人,特定類別醫療器械合規截止日期前,數據量和問題會急劇上升,FDA會招聘臨時工作人員,借以保障工作人員的充足。
積極溝通交流形成良好的實施氛圍也是至關重要的。美國FDA在法規制定和實施過程中多次召開研討會,征求企業的意見,并發布一系列指南和網絡教程。此外,行業組織自發形成聯盟,積極探討UDI實施有關問題,借以加強行業之間的溝通和交流,例如醫療保健資源和材料管理協會(The Association for Health Care Resource & Materials Man- agement,AHRMM)是醫療保健供應鏈專業人員的行業協會,其是美國醫院協會的組成部分,開發了學習UDI社區(LUC)【8】,著重討論如何在醫療保健領域實施UDI。
3.2美國FDA UDI實施面臨的挑戰
①數據維護及質量問題。醫療器械產品的上市狀態和新規格型號的不斷更新推出、企業的兼并重組等都會導致數據庫信息發生變化,因此UDI數據庫需要長期的更新和維護。與此同時,數據質量是UDI全面實施面臨的主要挑戰,雖然美國FDA在建立UDI數據庫中盡可能采取結構化的數據,如是否和下拉選項等方式,避免使用純文本,但企業填寫中還是存在不規范的現象,數據質量有待提高。
②部分企業合規難。據介紹,美國有8000家本土醫療器械生產廠商,全球范圍內注冊企業有16000家,有3000家進口商。雖然FDA針對小企業發布了(UDI系統:小企業依從性指南》,但因為企業類型、所處區域等不同,同時涉及到硬件購買以及人員培訓等,某些企業符合UDI規定尚有困難。對于一些特殊的醫療器械,如標簽尺寸過小無法張貼UDI標識的問題、組合包貼標問題、零售商現有掃碼系統不兼容等都給UDI實施帶來新的挑戰。
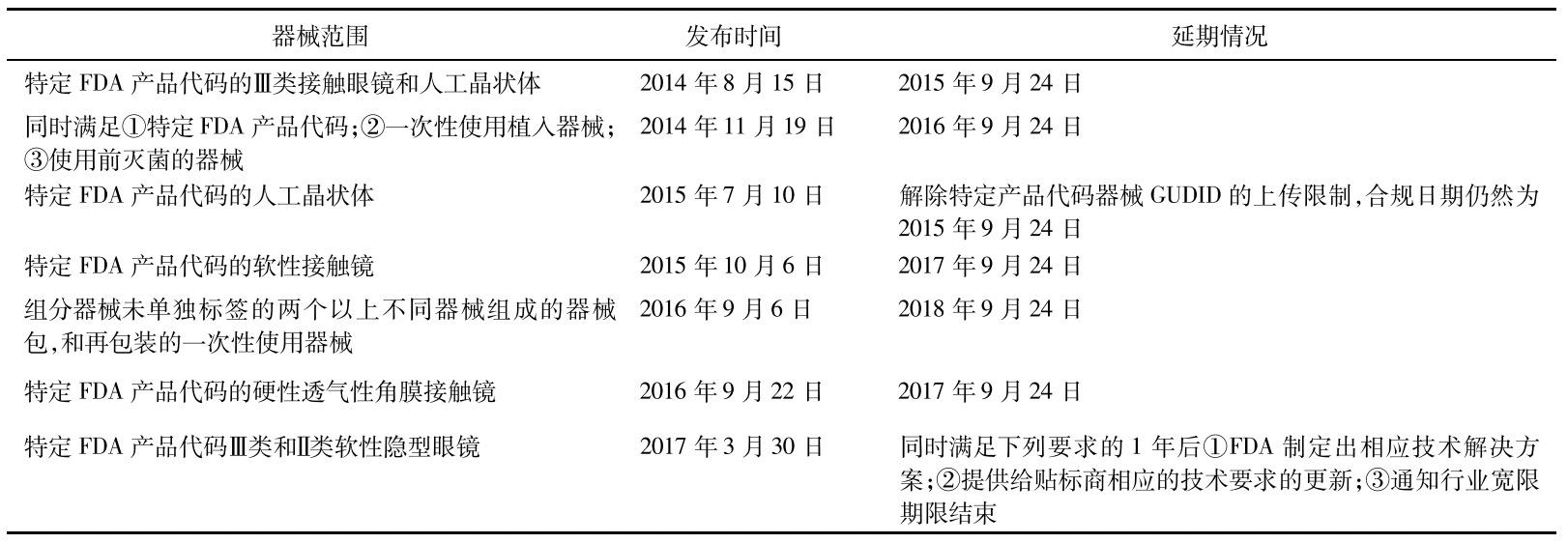
③部分類別醫療器械實施難度大。雖然美國FDA UDI法規明確了各類型醫療產品的合規日期,但是在實施UDI的過程中,由于醫療器械的多樣性,部分類型產品難以滿足法規要求,美國FDA發布了一系列的通知,推遲了特定類型產品的合規日期,對于某些特殊類別的產品,如軟性接觸鏡,FDA反復推遲實施日期直至尋找到合適的解決方案。見表2。
表2 美國FDAUDI系統特定產品合規日期的調整
4、美國FDA實施UDI對我國的啟示
美國FDA UDI法規已經發布6年時間,實施過程中有很多經驗可以借鑒,同時也暴露了一些問題需要重視和思考:
①UDI系統是一個醫療器械的充分識別系統,而不是追溯系統,由標識、載體和數據庫組成。數據庫是一個靜態數據庫,只包含產品的特征信息,不包括廠商的生產計劃、產品流向等動態信息。但如果各方都在他們的工作流程系統中記錄和使用UDI,就可以形成完整的追溯鏈條。
②由于醫療器械的多樣性,美國FDA UDI系統規則只是一個框架,給予企業實施更多的靈活性。但美國FDA也在實施過程中發布了一系列指南文件,借以更好地指導企業實施UDI。
③UDI實施是一個長期的系統性工程。美國從開始UDI研究到規格正式發布用了10多年的時間,法規發布后采取基于風險分階段實施的方式,前后加起來超過20年,UDI的實施應當循序漸進。
④溝通和交流有助于UDI的成功實施。美國FDA在法規制定和發布后大量并多次征求意見和召開討論會,美國的協會也自發成立了組織研究UDI實施中遇到的問題,形成了良好的實施氛圍。
⑤實施中的共性問題有必要明確。UDI實施中很多問題具備普遍性,如在實施初期政策法規和技術問題比較多,美國FDA針對UDI系統實施中的共性問題,制定了UDI常見問題集,有效地指導了行業的合規。



